แบบจำลองอะตอม









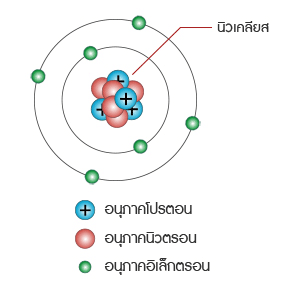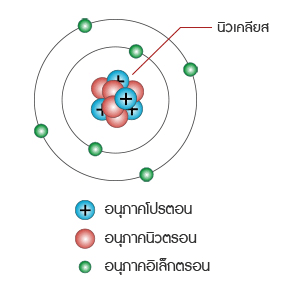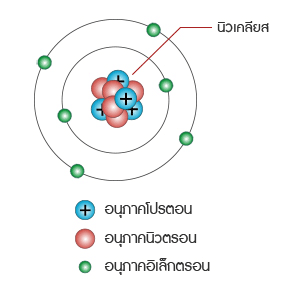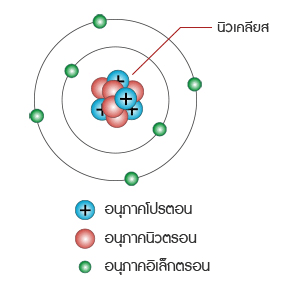

เลขมวล คือ ผลรวมของนิวตรอนและโปรตอนที่มีในนิวเคลียสของอะตอมของธาตุ นิวเคลียสในอะตอมอื่นๆ



เนื่องจากในปัจจุบันมีการค้นพบธาตุแล้วเป็นจำนวนมาก ธาตุเหล่านี้มีสมบัติบางประการที่คล้ายกันและแตกต่างกัน จึงยากที่จะจดจำสมบัติต่างๆและธาตุได้ทั้งหมด นักวิทยาศาสตร์จึงได้หาเกณฑ์ในการจัดกลุ่มธาตุที่มีลักษณะคล้ายๆกันเพื่อให้ง่ายต่อการศึกษา
วิวัฒนาการของการสร้างตารางธาตุ
ภายหลังการค้นพบธาตุต่างๆ และศึกษาสมบัติของธาตุเหล่านี้ นักวิทยาศาสตร์ได้หาความสัมพันธ์ระหว่างสมบัติต่างๆ ของธาตุและนำมาใช้จัดธาตุเป็นกลุ่มได้หลายลักษณะ ในปี พ.ศ.2360 (ค.ศ. 1817) โยฮันน์ เดอเบอไรเนอร์เป็นนักเคมีคนแรกที่พยายามจัดธาตุเป็นกลุ่มๆ ละ 3 ธาตุตามสมบัติที่คล้ายคลึงกันเรียกว่า ชุดสาม โดยพบว่าธาตุกลางจะมีมวลอะตอม *เป็นค่าเฉลี่ยของมวลอะตอมของอีกสองธาตุที่เหลือ ตัวอย่างธาตุชุดสามของเดอเบอไรเนอร์ เช่น Na เป็นธาตุกลางระหว่าง Li กับ K มีมวลอะตอม 23 ซึ่งเป็นค่าเฉลี่ยของมวลอะตอมของธาตุ Li ซึ่งมีมวลอะตอม 7 กับธาตุ K ซึ่งมีมวลอะตอม 39 แต่เมื่อนำหลักของชุดสามไปใช้กับธาตุกลุ่มอื่นที่มีสมบัติคล้ายกัน พบว่าค่ามวลอะตอมของ ธาตุกลางไม่เท่ากับค่าเฉลี่ยของมวลอะตอมของสองธาตุที่เหลือ หลักชุดสามของเดอเบอไรเนอร์จึงไม่เป็นที่ยอมรับในเวลาต่อมา
ในปี พ.ศ. 2407 จอห์น นิวแลนด์ นักวิทยาศาสตร์ชาวอังกฤษได้เสนอกฎในการจัดธาตุเป็นหมวดหมู่ว่า ถ้าเรียงธาตุตามมวลอะตอมจากน้อยไปมากพบว่าธาตุที่ 8 จะมีสมบัติเหมือนกับธาตุที่ 1 เสมอ (ไม่รวมธาตุไฮโดรเจนและแก๊สเฉื่อย) เช่น เริ่มต้นเรียงโดยใช้ธาตุ Li เป็นธาตุที่ 1 ธาตุที่ 8 จะเป็น Na ซึ่งมีสมบัติคล้ายธาตุ Li ดังตัวอย่างการจัดต่อไปนี้ และยังมีการจัดแบบรูปตารางธาตุของคนอื่นๆอีกมากมาย



1. Dolton's model
แบบจำลองอะตอมของจอร์น ดอลตัน

ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอม
เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้
1. ธาตุประกอบด้วยอนุภาคเล็กๆหลายอนุภาคเรียกอนุภาคเหล่านี้ว่า “อะตอม” ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน แต่จะมีสมบัติ แตกต่างจากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยา เคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
จอห์น ดอลตัน ชาวอังกฤษ เสนอทฤษฎีอะตอมของดอลตัน
- อะตอมเป็นอนุภาคที่เล็กที่สุด แบ่งแยกอีกไม่ได้
- อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน
- อะตอมต้องเกิดจากสารประกอบเกิดจากอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมตัวกันทางเคมี
ทฤษฎีอะตอมของดอลตันใช้อธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง แต่ต่อมานักวิทยาศาสตร์ค้นพบข้อมูลบางประการที่ไม่สอดคล้องกับทฤษฎีอะตอมของ ดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันอาจมีมวลแตกต่างกันได้
ลักษณะแบบจำลองอะตอมของดอลตัน

2.Sir Joseph John Thomson's Model
แบบจำลองอะตอมของทอมสัน
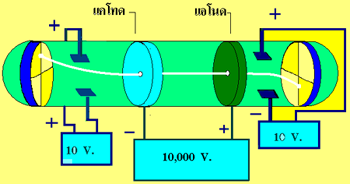
เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด

หลอดรังสีแคโทด
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด

3.E.R. Rutherford's Model
เออร์เนสต์ รัทเธอร์ฟอร์ด (Ernest Rutherford) ได้ทำการ

จาก
แต่
1.อิเล็กตรอน
2. อะตอมที่มีอิเล็กตรอนมาก
3. ประจุบวกที่รวมกันอยู่ในนิวเคลียส จะอยู่กัน

4.Niels Bohr's Model
นักวิทยาศาสตร์ได้พยายามศึกษาเรื่องเกี่ยวกับอะตอม โดยได้เสนอแบบจำลองอะตอมจากการทดลองที่เกิดขึ้น ซึ่งแบบจำลองของรัทเธอร์ฟอร์ดได้รับการยอมรับแต่ก็ยังไม่สมบูรณ์ จึงมีผู้พยายามหาคำอธิบายเพิ่มเติม

โดยในปี 1913 นีล โบร์ (Niels Bohr) นักวิทยาศาสตร์ชาวเดนมาร์ก ได้ทำการศึกษาการเกิดสเปกตรัมของก๊าซไฮโดรเจน และได้สร้างแบบจำลองอะตอมเพื่อใช้อธิบายลักษณะการเคลื่อนที่ของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว และเรียกระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุด ซึ่งมีระดับพลังงานต่ำที่สุด เรียกว่า ระดับพลังงาน K และเรียกระดับพลังงานถัดออกมาว่า ระดับพลังงาน L,M,N,… ตามลำดับ
วิธีทำการทดลอง
เขาศึกษาสเปกตรัมการเปล่งแสงของธาตุ โดยบรรจุแก๊สไฮโดรเจนในหลอดปล่อยประจุ จากนั้นให้พลังงานเข้าไป
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไป
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไป

ผลการทดลอง
อิเล็กตรอนเคลื่อนจากขั้วบวกไปขั้วลบชนกับแก๊สไฮโดรเจน จากนั้นเปล่งแสงออกมาผ่านปริซึมทำให้เราเห็นเป็นเส้นสเปกตรัมสีต่าง ๆ ตกบนฉากรับภาพ
อิเล็กตรอนเคลื่อนจากขั้วบวกไปขั้วลบชนกับแก๊สไฮโดรเจน จากนั้นเปล่งแสงออกมาผ่านปริซึมทำให้เราเห็นเป็นเส้นสเปกตรัมสีต่าง ๆ ตกบนฉากรับภาพ
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
ระดับพลังงานแต่ละชั้น
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
ระดับพลังงานแต่ละชั้น
นีลส์ โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา สรุปได้ดังนี้
1. อิเลคตรอนจะอยู่กันเป็นชั้น ๆ แต่ละชั้นเรียกว่า “ระดับพลังงาน” 2. แต่ละระดับพลังงานจะมีอิเลคตรอนบรรจุได้ดังนี้
จำนวนอิเลคตรอน = 2n2
ระดับพลังงาน K
ระดับพลังงาน L
ระดับพลังงาน M
ระดับพลังงาน N
ระดับพลังงาน O ระดับพลังงาน P ระดับพลังงาน Q
ระดับพลังงาน L
ระดับพลังงาน M
ระดับพลังงาน N
ระดับพลังงาน O ระดับพลังงาน P ระดับพลังงาน Q
3. อิเลคตรอนที่อยู่ในระดับพลังงานวงนอกสุดเรียกว่า เวเลนซ์อิเลคตรอน (Valent electron) จะเป็นอิเลคตรอนที่เกิดปฏิกิริยาต่าง ๆ ได้
4. อิเลคตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมาก เพราะประจุบวกจากนิวเคลียสดึงดูดไว้อย่างดี ส่วนอิเลคตรอนระดับพลังงานวงนอก จะไม่เสถียร เพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก อิเลคตรอนพวกนี้จึงมีพลังงานสูงหลุดออกจากอะตอมได้ง่าย 5. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมา 6. การเปลี่ยนระดับพลังงานของอิเลคตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยน ข้ามระดับพลังงานกันก็ได้
4. อิเลคตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมาก เพราะประจุบวกจากนิวเคลียสดึงดูดไว้อย่างดี ส่วนอิเลคตรอนระดับพลังงานวงนอก จะไม่เสถียร เพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก อิเลคตรอนพวกนี้จึงมีพลังงานสูงหลุดออกจากอะตอมได้ง่าย 5. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมา 6. การเปลี่ยนระดับพลังงานของอิเลคตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยน ข้ามระดับพลังงานกันก็ได้


5.Electron Cloud model of Atom
จากแบบจำลองอะตอมของโบร์ ไม่สามารถอธิบายสมบัติบางอย่างของธาตุที่มีหลายอิเล็กตรอนได้จึงมีการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาคการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาค

สรุปแบบจำลองอะตอมแบบกลุ่มหมอก
แบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
อนุภาคในอะตอมและไอโซโทป
อนุภาคในอะตอม อะตอมประกอบด้วยอนุภาคมูลฐานที่สำคัญ 3 อนุภาค ได้แก่ โปรตอน นิวตรอน และอิเล็กตรอน
โปรตอน อนุภาคชนิดนี้เป็นอนุภาคที่ถูกตรึงแน่นอยู่ในนิวเคลียส (Neucleus)มีอนุภาคเป็นบวกจำนวนโปรตอนใน อะตอมของธาตุเรียกว่า อะตอมมิค นัมเบอร์ ถ้าธาตุใดมีอะตอมมิค นัมเบอร์ เท่ากันเรียกธาตุเหล่านี้ว่าเป็นไอโซโทป ซึ่งกันและกันกล่าวคือ เป็นธาตุที่มีจำนวนโปรตอนเท่ากัน แต่มีจำนวนนิวตรอนต่างกัน
นิวตรอน
อนุภาคชนิดนี้เป็นอนุภาคที่ถูกตรึงแน่นอยู่ในนิวเคลียสรวมกับโปรตอนมีน้ำหนักมากกว่าโปรตอนเล็กน้อยและมีคุณ
สมบัติเป็นกลางทางไฟฟ้า ผลรวมระหว่างโปรตอนและนิวตรอนใน 1 อะตอมของธาตุ เราเรียกว่า อะตอมมิค แมส หรือ
แมส นัมเบอร์ ถ้าธาตุใดมีแมส นัมเบอร์ เท่ากันแต่อะตอมมิค นัมเบอร์ ไม่เท่ากันเรา เรียกธาตุเหล่านี้ว่าเป็นไอโซบาร์
ซึ่งกันและกัน
อิเล็กตรอน
นิวตรอน
อนุภาคชนิดนี้เป็นอนุภาคที่ถูกตรึงแน่นอยู่ในนิวเคลียสรวมกับโปรตอนมีน้ำหนักมากกว่าโปรตอนเล็กน้อยและมีคุณ
สมบัติเป็นกลางทางไฟฟ้า ผลรวมระหว่างโปรตอนและนิวตรอนใน 1 อะตอมของธาตุ เราเรียกว่า อะตอมมิค แมส หรือ
แมส นัมเบอร์ ถ้าธาตุใดมีแมส นัมเบอร์ เท่ากันแต่อะตอมมิค นัมเบอร์ ไม่เท่ากันเรา เรียกธาตุเหล่านี้ว่าเป็นไอโซบาร์
ซึ่งกันและกัน
อิเล็กตรอน
อนุภาคชนิดนี้มีคุณสมบัติทางไฟฟ้าเป็นประจุลบ วิ่งอยู่รอบ ๆ นิวเคลียสของอะตอมของธาตุด้วยความเร็วสูงในวงโคจร ที่เฉพาะของมัน เป็นอนุภาคที่มีน้ำหนักน้อย หนักประมาณ เท่าของน้ำหนักของโปรตอนอิเล็กตรอนจะได้รับแรง ดึงดูดจากโปรตอนในนิวเคลียสถ้าอิเล็กตรอนเหล่านั้นได้รับพลังงานเพิ่มมันอาจจะ กระโดดออกไปยังเซลล์ต่อไปได้ อิเล็กตรอนในเซลล์รอบนอกสุดมีบทบาทสำคัญมากทั้งในด้านคุณสมบัติทางฟิสิกส์และเคมี โดยเฉพาะในด้านไฟฟ้า อิเล็กตรอนในเซลล์นี้เรียกว่า เวเลนซ์อิเล็กตรอน ถ้าอิเล็กตรอนในเซลล์นี้ได้รับพลังงานเพิ่มมันจะกระโดดหายไปจากอะตอมของธาตุ ทำให้อะตอมมีลักษณะพร่องอิเล็กตรอนจึงมี สภาพทางไฟฟ้าเป็นบวก ในทางตรงกันข้ามถ้ามันสูญเสีย พลังงาน มันจะ ได้รับอิเล็กตรอนเพิ่มทำให้มีสภาพ ้ทางไฟฟ้าเป็นลบ ดังนั้นอิเล็กตรอนเท่านั้นที่เคลื่อนที่ได้ จึงทำให้เกิด การไหลของกระแสไฟฟ้าโดยปกติสารที่เป็นกลางทางไฟฟ้าจะมีโปรตอนและอิเล็กตรอนเท่ากัน สารใดสูญเสียอิเล็กตรอนจะมี คุณสมบัติทาง ไฟฟ้าเป็นบวก สารใดที่รับอิเล็กตรอนเพิ่มจะมีคุณสมบัติทางไฟฟ้าเป็นลบ

เลขอะตอม เลขมวล และไอโซโทป
จากการศึกษาเกี่ยวกับโครงสร้างของอะตอม โดยมีข้อมูลต่างๆ จากการทดลองมาสนับสนุน สรุปได้ว่า อะตอมของธาตุต่างๆ จะประกอบด้วยอิเล็กตรอน โปรตอนและนิวตรอน (ยกเว้นอะตอมของธาตุไฮโดรเจน ที่ไม่มีนิวตรอน) ซึ่งมีจำนวนแตกต่างกันไป

เลขอะตอม คือ จำนวนโปรตอนในนิวเคลียสของแต่ละอะตอมของธาตุ ในอะตอมที่เป็นกลางจะมีจำนวนโปรตอนเท่ากับจ้านวนอิเล็กตรอน ดังนั้นเลขเชิงอะตอมจึงบอกจำนวนของอิเล็กตรอนของธาตุได้ด้วย เนื่องจากอะตอมของธาตุชนิดเดียวกันมีค่าเลขเชิงอะตอมเท่ากันเสมอ เลขเชิงอะตอมจึงป็นเอกลักษณ์ของธาตุชนิดเดียวกัน เช่น เลขเชิงอะตอมของฟอสฟอรัสเท่ากับ 15 นั้นคือทุกๆ อะตอมที่เป็นกลางของฟอสฟอรัสจะมี 15 โปรตอน และมี 15 อิเล็กตรอน และกล่าวได้ว่าอะตอมใดๆ ในจักรวาลถ้ามี 15 โปรตอนแล้ว จะเรียกว่า “ฟอสฟอรัส” ทั้งสิ้น
เลขมวล คือ ผลรวมของนิวตรอนและโปรตอนที่มีในนิวเคลียสของอะตอมของธาตุ นิวเคลียสในอะตอมอื่นๆ
ทั้งหมดจะมีทั้งโปรตอนและนิวตรอนอยู่ โดยทั่วไปแล้วเลขมวลหาได้ดังนี้
________เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
______________ = เลขอะตอม + จำนวนนิวตรอน
______จำนวนนิวตรอนในอะตอม = เลขมวล – เลขอะตอม
_ไอโซโทป (isotope) หมายถึง อะตอมของธาตุชนิดเดียวกันที่มีเลขอะตอม (Z) เท่ากัน แต่เลขมวล (A) ไม่เท่ากัน สมบัติทางเคมีของธาตุถูกก้าหนดโดยจำนวนโปรตอนและอิเล็กตรอนในอะตอม นิวตรอนไม่มีส่วนเกี่ยวข้องในการเปลี่ยนแปลงทางเคมีตามปกติ ดังนั้นไอโซโทปของธาตุเดียวกันจึงมีสมบัติทางเคมีเหมือนกันเกิดสารประกอบประเภทเดียวกันและมีความไวต่อปฏิกิริยาเคมีทำนอง
การจัดเรียงอิเล็กตรอนในอะตอม
จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน อิเล็กตรอนในอะตอมที่อยู่ ณ ระดับพลังงาน (energy levels หรือ shell) จะมีพลังงานจำนวนหนึ่ง ส้าหรับอิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะมีพลังงานน้อยกว่าพวกที่อยู่ไกลออกไป ยิ่งอยู่ไกลมากยิ่งมีพลังงานมากขึ้น โดยกำหนดระดับพลังงานหลักให้เป็น n ซึ่ง n เป็นจ้านวนเต็มคือ 1, 2, … หรือตัวอักษรเรียงกันดังนี้ คือ K, L, M, N, O, P, Q ตามล้าดับ เมื่อ n = 1 จะเป็นระดับพลังงานต่ำสุด หมายความว่า จะต้องใช้พลังงานมากที่สุดที่จะดึงเอาอิเล็กตรอนนั้นออกจากอะตอมได้ จำนวนอิเล็กตรอนที่จะมีได้ในแต่ละระดับพลังงานหลักต้องเท่ากับหรือไม่เกิน 2n2 และจำนวนอิเล็กตรอนในระดับนอกสุดจะต้องไม่เกิน 8

ระดับพลังงานหลัก และระดับพลังงานย่อย
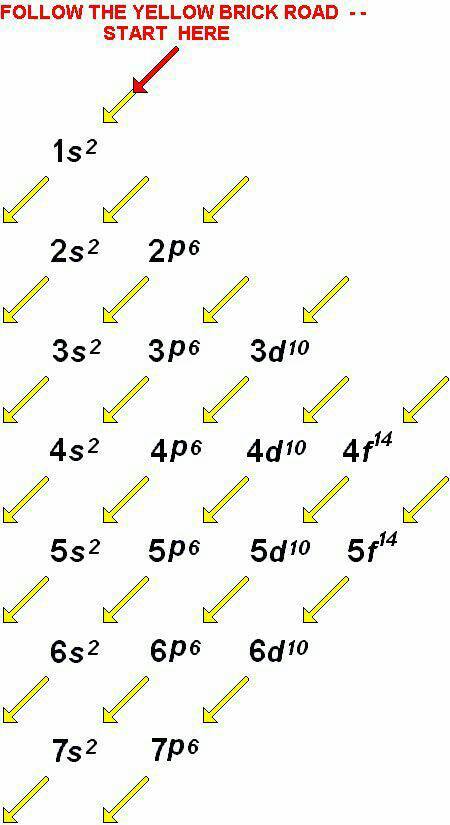
การจัดอิเล็กตรอนในระดับพลังงานหลัก ทำให้แต่ละระดับพลังงานมีจำนวนอิเล็กตรอนมากจึงเกิดปัญหาว่าอิเล็กตรอนเหล่านั้นอยู่ในระดับพลังงานเดียวกันได้อย่างไร ทำไมจึงไม่ผลักกัน เพื่อแก้ปัญหาดังกล่าว นักวิทยาศาสตร์จึงได้ศึกษาเกี่ยวกับระดับพลังงานย่อยเพื่อกระจายอิเล็กตรอนในแต่ละระดับพลังงานหลัก เข้าสู่ระดับพลังงานย่อย โดยอาศัยรูปแบบโคจรของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นเกณฑ์ในการแบ่งอิเล็กตรอนเป็นกลุ่มย่อย ๆ และเรียกรูปแบบวงโคจรนี้ว่าออร์บิทัล (Orbital) โดย 1 ออร์บิทัลจะมีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน ระดับพลังงานย่อยมี 4 ระดับ คือ s, p, d, f โดยระดับพลังงานย่อยมี
s มี 1 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 2 อิเล็กตรอน
p มี 3 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 6 อิเล็กตรอน
d มี 5 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 10 อิเล็กตรอน
f มี 7 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 14 อิเล็กตรอน
จัดอิเล็กตรอนในระดับพลังงานย่อย ต่าง ๆ จะต้องจัดเข้าในระดับพลังงานย่อยที่มีพลังงานต่ำสุดก่อนแล้วจึงจัดเข้าสู่ระดับพลังงานย่อยที่มีพลังงานสูงขึ้น(ตามหลักของเอาฟบาว) ดังแผนผังต่อไปนี้

ออร์บิทัล
เนื่องจากอิเล็กตรอนมีการเคลื่อนที่ตลอดเวลา ความหนาแน่นของกลุ่มหมอกอิเล็กตรอนจึงอยู่ในรูปของ โอกาสที่จะพบอิเล็กตรอน ซึ้งมา 2 สี

หลักการจัดเรียงอิเล็กตรอนในอะตอม
Aufbau เป็นภาษาเยอรมัน ซึ่งมีความหมายตรงกับคำในภาษาอังกฤษว่า "build up" ดังนั้น หลักเอาฟบาว คือ "หลักการวางอิเล็กตรอนเพื่อสร้างอะตอม" กล่าวไว้ว่า

ตารางธาตุและสมบัติของธาตุหมู่หลัก
เนื่องจากในปัจจุบันมีการค้นพบธาตุแล้วเป็นจำนวนมาก ธาตุเหล่านี้มีสมบัติบางประการที่คล้ายกันและแตกต่างกัน จึงยากที่จะจดจำสมบัติต่างๆและธาตุได้ทั้งหมด นักวิทยาศาสตร์จึงได้หาเกณฑ์ในการจัดกลุ่มธาตุที่มีลักษณะคล้ายๆกันเพื่อให้ง่ายต่อการศึกษา
วิวัฒนาการของการสร้างตารางธาตุ
ภายหลังการค้นพบธาตุต่างๆ และศึกษาสมบัติของธาตุเหล่านี้ นักวิทยาศาสตร์ได้หาความสัมพันธ์ระหว่างสมบัติต่างๆ ของธาตุและนำมาใช้จัดธาตุเป็นกลุ่มได้หลายลักษณะ ในปี พ.ศ.2360 (ค.ศ. 1817) โยฮันน์ เดอเบอไรเนอร์เป็นนักเคมีคนแรกที่พยายามจัดธาตุเป็นกลุ่มๆ ละ 3 ธาตุตามสมบัติที่คล้ายคลึงกันเรียกว่า ชุดสาม โดยพบว่าธาตุกลางจะมีมวลอะตอม *เป็นค่าเฉลี่ยของมวลอะตอมของอีกสองธาตุที่เหลือ ตัวอย่างธาตุชุดสามของเดอเบอไรเนอร์ เช่น Na เป็นธาตุกลางระหว่าง Li กับ K มีมวลอะตอม 23 ซึ่งเป็นค่าเฉลี่ยของมวลอะตอมของธาตุ Li ซึ่งมีมวลอะตอม 7 กับธาตุ K ซึ่งมีมวลอะตอม 39 แต่เมื่อนำหลักของชุดสามไปใช้กับธาตุกลุ่มอื่นที่มีสมบัติคล้ายกัน พบว่าค่ามวลอะตอมของ ธาตุกลางไม่เท่ากับค่าเฉลี่ยของมวลอะตอมของสองธาตุที่เหลือ หลักชุดสามของเดอเบอไรเนอร์จึงไม่เป็นที่ยอมรับในเวลาต่อมา
ในปี พ.ศ. 2407 จอห์น นิวแลนด์ นักวิทยาศาสตร์ชาวอังกฤษได้เสนอกฎในการจัดธาตุเป็นหมวดหมู่ว่า ถ้าเรียงธาตุตามมวลอะตอมจากน้อยไปมากพบว่าธาตุที่ 8 จะมีสมบัติเหมือนกับธาตุที่ 1 เสมอ (ไม่รวมธาตุไฮโดรเจนและแก๊สเฉื่อย) เช่น เริ่มต้นเรียงโดยใช้ธาตุ Li เป็นธาตุที่ 1 ธาตุที่ 8 จะเป็น Na ซึ่งมีสมบัติคล้ายธาตุ Li ดังตัวอย่างการจัดต่อไปนี้ และยังมีการจัดแบบรูปตารางธาตุของคนอื่นๆอีกมากมาย

ตารางการจัดหมวดหมู่แบบ John Newlands

ตารางธาตุของเมนเดเลเอฟ

ตารางธาตุของเมนเดเลเอฟที่เกิดจากการจัดเรียงของ Henry Mosley (ตารางธาตุในปัจจุบัน)
แถวแนวนอนในตารางธาตุจะเรียกว่า คาบ และแถวในแนวตั้งเรียกว่า หมู่ โดยหมู่บางหมู่จะมีชื่อเฉพาะ เช่นแฮโลเจน หรือแก๊สมีตระกูล โดยคำนิยามของตารางธาตุ ตารางธาตุยังมีแนวโน้มของสมบัติของธาตุ เนื่องจากเราสามารถใช้ตารางธาตุบอกความสัมพันธ์ระหว่างสมบัติของธาตุแต่ละตัว และใช้ทำนายสมบัติของธาตุใหม่ ธาตุที่ยังไม่ถูกค้นพบ หรือธาตุที่สังเคราะห์ขึ้น และด้วยความพิเศษของตารางธาตุ ทำให้มันถูกใช้อย่างกว้างขวางในการศึกษาวิชาเคมีหรือวิทยาศาสตร์สาขาอื่น ๆ
ขนาดไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอน เมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออน นักเรียนคิดว่าขนาดของไอออนกับขนาดอะตอมของธาตุเดียวกันจะแตกต่างกันหรือไม่
การบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม กล่าวคือจะบอกเป็นค่ารัศมีไอออน ซึ่งพิจารณาจากระยะระหว่างนิวเคลียสของไอออนคู่หนึ่งๆ ที่มีแรงยึดเหนี่ยวซึ่งกันและกันในโครงผนึก
เปรียบเทียบขนาดอะตอมกับขนาดไอออน
กลุ่มของธาตุในตารางธาตุ
จากรูปของตารางธาตุในปัจจุบันจาก หัวข้อที่แล้ว ตารางธาตุมาตรฐานจะมี 18 หมู่และ 7 คาบ และมีคาบพิเศษเพิ่มเติมมาอยู่ด้านล่างของตารางธาตุ ตารางยังสามารถเปลี่ยนเป็นการจัดเรียงตามบล็อก โดย บล็อก -s จะอยู่ซ้ายมือ บล็อก -p จะอยู่ขวามือ บล็อก -d จะอยู่ตรงกลางและบล็อก -f อยู่ที่ด้านล่าง และยังมีการแบ่งแบบ ธาตุโลหะ ธาตุกึ่งโลหะ และธาตุอโลหะ
แถวแนวนอนในตารางธาตุจะเรียกว่า คาบ และแถวในแนวตั้งเรียกว่า หมู่ โดยหมู่บางหมู่จะมีชื่อเฉพาะ เช่นแฮโลเจน หรือแก๊สมีตระกูล โดยคำนิยามของตารางธาตุ ตารางธาตุยังมีแนวโน้มของสมบัติของธาตุ เนื่องจากเราสามารถใช้ตารางธาตุบอกความสัมพันธ์ระหว่างสมบัติของธาตุแต่ละตัว และใช้ทำนายสมบัติของธาตุใหม่ ธาตุที่ยังไม่ถูกค้นพบ หรือธาตุที่สังเคราะห์ขึ้น และด้วยความพิเศษของตารางธาตุ ทำให้มันถูกใช้อย่างกว้างขวางในการศึกษาวิชาเคมีหรือวิทยาศาสตร์สาขาอื่น ๆ
ขนาดอะตอม
จากการศึกษาโครงสร้างอะตอมตามทฤษฎีของโบร์ (Bohr Theory) อิเล็กตรอนในอะตอมจะมีระดับพลังงานได้หลายค่า และเมื่ออิเล็กตรอนอยู่ห่างนิวเคลียสมากก็จะยิ่งมีพลังงานสูง ดังนั้นขนาดของอะตอมจะเล็กหรือใหญ่จึงขึ้นอยู่กับอิเล็กตรอนในชั้นนอกสุดว่าอยู่ในระดับพลังงานใด และขึ้นอยู่กับจำนวนโปรตอนในนิวเคลียส ซึ่งจะมีความสัมพันธ์กับหมู่และคาบของธาตุในตารางธาตุด้วย เมื่อจะศึกษาแนวโน้มของขนาดอะตอมจึงต้องพิจารณาแนวโน้มของขนาดอะตอมตามหมู่และตามคาบ เนื่องจากแนวโน้มนี้จะแปรเปลี่ยนไปตามเลขอะตอมที่เพิ่มขึ้นและจำนวนระดับพลังงานของอิเล็กตรอน

การวัดขนาดที่แน่นอนของอะตอมเป็นสิ่งที่ทำได้ยาก เพราะการกระจายของอิเล็กตรอนในอะตอมตามแบบจำลองอะตอมแบบกลุ่มหมอกนั้นบอกไม่ได้ว่าสิ้นสุดตรงไหนเพียงแต่คาดว่าเมื่อไกลนิวเคลียสออกไปมาก ๆ โอกาสที่จะพบอิเล็กตรอนมีน้อยจนเกือบเป็นศูนย์ และการที่จะแยกอะตอมออกมาเพียงอะตอมเดียวเพื่อวัดขนาดให้แน่นอนก็ทำไม่ได้เพราะอะตอมมีขนาดเล็กมาก นักเคมีมีวิธีที่จะบอกขนาดของอะตอมได้เมื่ออะตอมรวมกันเกิดเป็นโมเลกุล โดยกำหนดให้อะตอมมีรูปร่างเป็นทรงกลม การบอกขนาดอะตอมจึงบอกเป็นรัศมีอะตอม (Atomic radius) รัศมีอะตอมมี 3 แบบ คือรัศมีโคเวเลนต์ รัศมีแวนเดอร์วาลส์ และรัศมีไอออน
ขนาดไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอน เมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออน นักเรียนคิดว่าขนาดของไอออนกับขนาดอะตอมของธาตุเดียวกันจะแตกต่างกันหรือไม่
การบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม กล่าวคือจะบอกเป็นค่ารัศมีไอออน ซึ่งพิจารณาจากระยะระหว่างนิวเคลียสของไอออนคู่หนึ่งๆ ที่มีแรงยึดเหนี่ยวซึ่งกันและกันในโครงผนึก
เปรียบเทียบขนาดอะตอมกับขนาดไอออน
พลังงานไอออไนเซชัน (IE)
พลังงานไอออไนเซชัน คือ พลังงานที่ใช้ในการทำให้อิเล็กตรอนหลุดออก จากอะตอมของธาตุในสภาพวะของธาตุในสภาวะก๊าซ
ธาตุในหมู่เดียวกัน ค่า IE1 จะลดลง เมื่อเลขอะตอมเพิ่มขึ้นระดับพลังงานของ เวเลนซ์อิเล็กตรอนเพิ่มขึ้น ซึ่งเป็นการเพิ่มระยะห่างระหว่างอิเล็กตรอนกับนิวเคลียส ทำให้แรงดึงดูดระหว่างนิวเคลียสกับอิเล็กตรอนลดลง IE1 จึงมีค่าน้อย( อิเล็กตรอนหลุดได้ง่าย )
ธาตุในคาบเดียวกัน ค่า IE1 จะเพิ่มขึ้นเมื่อเลขอะตอมเพิ่มขึ้น เนื่องจากขนาด ของอะตอมจะเล็กลงตามคาบ แรงดึงดูดระหว่างนิวเคลียสกับอิเล็กตรอนมีค่าเพิ่มขึ้น จึงต้องใช้พลังสูงขึ้นในการดึงอิเล็กตรอน ( IE1 มีค่าเพิ่มขึ้น )
พลังงานไอออไนเซชัน หรือ IE คือ พลังงานปริมาณน้อยที่สุดที่สามารถดึงอิเล็กตรอนหลุดออกจากอะตอมในสถานะแก็ว เช่น การทำให้ไฮโดรเจนไอออนในสถานะแก็ส การทำให้อิเล็กตรอนหลุดออกจากอะตอมของ H จะต้องใช้พลังงานอย่างน้อย 2.19 x 10-18 J ต่อ อะตอม หรือ 1318 กิโลจูลต่อโมล
สัมพรรคภาพอิเล็กตรอน (Electron affinity : EA)
สัมพรรคภาพอิเล็กตรอน (electron affinity : EA) หมายถึงพลังงานที่อะตอมในสถานะแก๊สคายออกเมื่ออะตอมได้รับอิเล็กตรอน 1 อิเล็กตรอน ซึ่งเขียนสมการแสดงการเปลี่ยนแปลงพลังงานได้ดังนี้
A(g) + e– A–(g) + DE
EA มีค่าเป็นลบ (–) เนื่องจากมีการคายพลังงานออกมา แสดงว่าอะตอมนั้นมีแนวโน้มที่จะรับอิเล็กตรอนเข้ามาได้ดี ความสามารถในการรับอิเล็กตรอนของแต่ละธาตุมีความแตกต่างกัน ดังตัวอย่าง
F(g) + e– F– (g) EA = –333 kJ/mol
O(g) + e– O– (g) EA = –142 kJ/mol
P(g) + e– P– (g) EA = –74 kJ/mol
จากตัวอย่างแสดงว่า F มีแนวโน้มรับอิเล็กตรอนได้สูงกว่า O และ P ตามลำดับ เมื่ออะตอมของธาตุรับ 1 อิเล็กตรอนแล้ว การรับอิเล็กตรอนเพิ่มขึ้นอีก 1 อิเล็กตรอนจะรับได้ยากขึ้น ดังนั้นค่า EA จึงมีค่าสูงขึ้นจนเป็นบวกได้ เช่น
O–(g) + e– O2–(g) EA = 780 kJ/mol
โลหะมีแนวโน้มที่จะเสียอิเล็กตรอน โดยทั่วไปค่า EA ของโลหะจึงมีค่าเป็นลบน้อย ๆ ถึงค่าบวกน้อย ๆ
ตัวเลขในวงเล็บได้จากการคำนวณและ เครื่องหมาย ? คือยังไม่ทราบค่าที่ชัดเจน
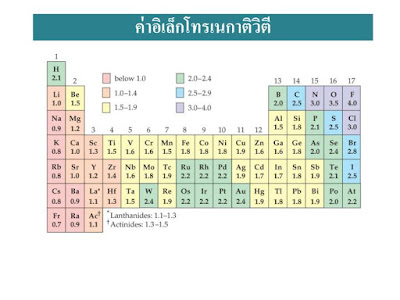
อิเล็กโทรเนกาติวิตี (Electronegativity : EN)
อิเล็กโทรเนกาติวิตี (electronegativity : EN) หมายถึงค่าที่แสดงความสามารถในการดึงดูดอิเล็กตรอนของอะตอมคู่ที่เกิดพันธะที่จะรวมกันเป็นโมเลกุล ธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูงตะมีความสามารถในการดึงดูดหรือรับอิเล็กตรอนได้ดี ได้แก่พวกอโลหะ ส่วนธาตุที่มีค่าอิเล็กโทรเนกาติวิตีต่ำจะดึงดูดหรือรับอิเล็กตรอนได้ไม่ดี ได้แก่พวกโลหะ เช่น โมเลกุลของ HCl เนื่องจาก Cl ดึงดูดอิเล็กตรอนได้ดีกว่า H ดังนั้น Cl จึงมีค่าอิเล็กโทรเนเติวิตีสูงกว่า H แนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุในตารางธาตุเป็นดังนี้
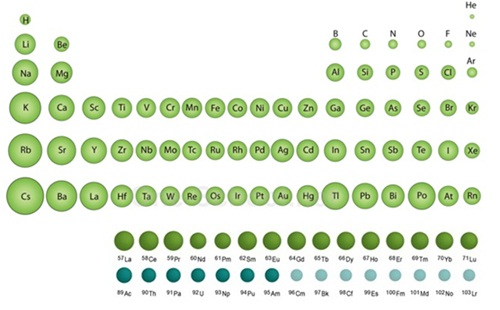
ธาตุแทรนซิชัน
นักเรียนได้ศึกษาสมบัติบางประการของธาตุหมู่ A มาแล้ว ต่อไปจะได้ศึกษาธาตุอีกกลุ่มหนึ่งซึ่งอยู่ระหว่างธาตุหมู่ IIA และหมู่ IIIA ที่เรียกว่า ธาตุแทรนซิชัน ประกอบด้วยธาตุหมู่ IB ถึงหมู่ VIIIB รวมทั้งกลุ่มแลนทาไนด์กับกลุ่มแอกทิไนด์ ดังรูป

จากการศึกษาไอโซโทปของธาตุจำนวนมากทำให้ได้ข้อสังเกตว่า ไอโซโทปของนิวเคลียสที่มีอัตราส่วนระหว่างจำนวนนิวตรอนต่อจำนวนโปรตอนไม่เหมาะสมคือนิวเคลียสที่มีจำนวนนิวตรอนแตกต่างจากจำนวนโปรตอนมากเกินไปจะไม่เสถียร จึงเกิดการเปลี่ยนแปลงภายในนิวเคลียสแล้วเกิดเป็นนิวเคลียสของธาตุใหม่ที่เสถียรกว่าโดยการแผ่รังสีออกมา ดังตัวอย่างต่อไปนี้
การแผ่รังสีบีตา เกิดกับนิวเคลียสที่มีจำนวนนิวตรอนมากกว่าโปรตอน นิวตรอนในนิวเคลียสจะเปลี่ยนไปเป็นโปรตอนและอิเล็กตรอน เมื่อปล่อยรังสีบีตาออกมานิวเคลียสใหม่จะมีเลขอะตอมเพิ่มขึ้น 1 เลขมวลยังคงเดิมดังตัวอย่าง
ธาตุแทรนซิชันเหล่านี้มีอยู่ทั้งในธรรมชาติและได้จากการสังเคราะห์ บางธาตุเป็นธาตุกัมมันตรังสีธาตุแทรนซิชันมีสมบัติอย่างไร จะได้ศึกษาต่อไป
สมบัติของธาตุแทรนซิชัน
นักเคมีจัดธาตุแทรนซิชันไว้ในกลุ่มของธาตุที่เป็นโลหะ แต่ไม่ได้เป็นกลุ่มเดียวกับธาตุหมู่ IA IIA และ IIIA เพราะเหตุใดจึงจัดธาตุแทรนซิชันไว้อีกกลุ่มหนึ่ง เพื่อตอบคำถามนี้ให้ศึกษาสมบัติของธาตุแทรนซิชันเปรียบเทียบกับสมบัติของธาตุหมู่ IA และ IIA ที่อยู่ในคาบเดียวกันจากตาราง
สารประกอบของธาตุแทรนซิชัน
สารเคมีที่ได้ศึกษามาแล้ว เช่น KmNo4 และ CuSO4 เป็นสารประกอบของธาตุแทรนซิชัน สารประกอบของธาตุในกลุ่มนี้แตกต่างจากสารประกอบของโลหะในกลุ่ม A อย่างไร นักเรียนจะได้ศึกษาสมบัติของสารประกอบของโครเมียมและแมงกานีส เพื่อเป็นแนวทางในการศึกษาสมบัติของธาตุแทรนซิชันอื่นๆ ต่อไป
ธาตุกัมมันตรังสี
ธาตุอีกกลุ่มหนึ่งในตารางธาตุซึ่งมีสมบัติแตกต่างจากธาตุที่เคยศึกษามาแล้ว กล่าวคือสามารถแผ่รังสีแล้วกลายเป็นอะตอมของธาตุใหม่ได้ การเปลี่ยนแปลงเหล่านี้เกิดขึ้นได้อย่างไร
ในปี ค.ศ. 1896 (พ.ศ.2439) อองตวน อองรีแบ็กเกอเรล นักวิทยาศาสตร์ชาวฝรั่งเศส พบว่าเมื่อเก็บแผ่นฟิล์มถ่ายรูปที่หุ้มด้วยกระดาษสีดำไว้กับสารประกอบของยูเรเนียม ฟิล์มจะมีลักษณะเหมือนถูกแสง และเมื่อทำการทดลองมีสารประกอบของยูเรเนียมชนิดอื่นๆ ก็ได้ผล เช่นเดียวกัน จึงสรุปว่าน่าจะมีรังสีแผ่ออกมาจากธาตุยูเรเนียม
ต่อมาปีแอร์ และมารี กูรี ได้ค้นพบว่าธาตุพอโลเนียมเรเดียม และทอเรียม ก็สามารถแผ่รังสีได้เช่นเดียวกันปรากฎการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่องเช่นนี้เรียกว่า กัมมันตภาพรังสี เป็นการเปลี่ยนแปลงภายในนิวเคลียสของไอโซโทปที่ไม่เสถียรและเรียกธาตุที่มีสมบัติเช่นนี้ว่า ธาตุกัมมันตรังสี ธาตุกัมมันตรังสีส่วนใหญ่มีเลขอะตอมสูงกว่า 83 แต่มีธาตุกัมมันตรังสีบางชนิดที่มีเลขอะตอมน้อยกว่า 83 เช่นในธรรมชาติพบธาตุกัมมันตรังสีหลายชนิดเช่น และหรืออาจเขียน U-238 U-235 Th-232 และ Rn-222 ก็ได้ นอกจากนี้นักวิทยาศาสตร์ยังสังเคราะห์ธาตุกัมมันตรังสีขึ้นเพื่อใช้ประโยชน์ในด้านต่างๆ ได้อีก
ต่อมาปีแอร์ และมารี กูรี ได้ค้นพบว่าธาตุพอโลเนียมเรเดียม และทอเรียม ก็สามารถแผ่รังสีได้เช่นเดียวกันปรากฎการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่องเช่นนี้เรียกว่า กัมมันตภาพรังสี เป็นการเปลี่ยนแปลงภายในนิวเคลียสของไอโซโทปที่ไม่เสถียรและเรียกธาตุที่มีสมบัติเช่นนี้ว่า ธาตุกัมมันตรังสี ธาตุกัมมันตรังสีส่วนใหญ่มีเลขอะตอมสูงกว่า 83 แต่มีธาตุกัมมันตรังสีบางชนิดที่มีเลขอะตอมน้อยกว่า 83 เช่นในธรรมชาติพบธาตุกัมมันตรังสีหลายชนิดเช่น และหรืออาจเขียน U-238 U-235 Th-232 และ Rn-222 ก็ได้ นอกจากนี้นักวิทยาศาสตร์ยังสังเคราะห์ธาตุกัมมันตรังสีขึ้นเพื่อใช้ประโยชน์ในด้านต่างๆ ได้อีก

การเกิดกัมมันตภาพรังสี
กัมมันตภาพรังสีเป็นปรากฎการณ์ทางธรรมชาติของสาร เกิดจากธาตุกัมมันตรังสี เช่น U-238 และ Th-232 แผ่รังสีออกมาตลอดเวลา ทั้งนี้เพราะนิวเคลียสของธาตุกัมมันตรังสีมีพลังงานสูงมากและไม่เสถียร จึงปล่อยพลังงานออกมาในรูปของอนุภาคหรือรังสีบางชนิด แล้วธาตุเหล่านั้นก็จะเปลี่ยนเป็นธาตุใหม่ ต่อมารัทเทอร์ฟอร์ดได้ศึกษาเพิ่มเติมและแสดงให้เห็นว่ารังสีที่แผ่ออกมาจากธาตุกัมมันตรังสีอาจเป็นรังสีแอลฟา บีตาหรือแกมมา ที่มีสมบัติแตกต่างกันดังตาราง
สมบัติของรังสีบางชนิด
การสลายตัวของไอโซโทปกัมมันตรังสี
การแผ่รังสีแอลฟา ส่วนใหญ่เกิดกับนิวเคลียสที่มีและอะตอมสูงกว่า 82 และมีจำนวนนิวตรอนต่อโปรตอนในสัดส่วนที่ไม่เหมาะสม เมื่อปล่อยรังสีแอลฟาออกมาจะกลายเป็นนิวเคลียสของธาตุใหม่ที่เสถียรซึ่งมีเลขอะตอมลดลง 2 เลขมวลลดลง 4
การแผ่รังสีแกมมา เกิดกับไอโซโทปกัมมันตรังสีที่มีพลังงานสูงมาก หรือไอโซโทปที่สลายตัวให้รังสีแอลฟาหรือบีตา แต่นิวเคลียสที่เกิดใหม่ยังไม่เสถียรเพราะมีพลังงานสูงจึงเกิดการเปลี่ยนแปลงในนิวเคลียสเพื่อให้มีพลังงานต่ำลงโดยปล่อยพลังงานส่วนเกินออกมาเป็นรังสีแกมมาดังตัวอย่าง
อันตรายจากไอโซโทปกัมมันตรังสี
กิจวัตรประจำวันต่างๆของมนุษย์ล้วนมีโอกาสที่จะทำให้ร่างกายได้รับ รังสีจากโอโซโทปกัมมันตรังสีทั้งสิ้น หากได้รับรังสีในปริมาณเล็กน้อยร่างกายสามารถฟื้นตัวได้ทัน แต่หากเกิด 100 มิลลิซีเวิร์ต เข้าไปจะเกิดความเสี่ยงต่อร่างกายได้
ครึ่งชีวิตของไอโซโทปกัมมันตรังสี
ธาตุกัมมันตรังสีจะสลายตัวให้รังสีชนิดใดชนิดหนึ่งออมาได้เองตลอดเวลา ธาตุกัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกัน ปริมาณการสลายตัวของธาตุกัมมันตรังสีจะบอกเป็น ครึ่งชีวิต ใช้สัญลักษณ์ t1/2 ครึ่งชีวิต หมายถึง ระยะเวลาที่นิวเคลียสของธาตุกัมมันตรังสี สลายตัวจนเหลือครึ่งหนึ่งของปริมาณเดิม ไอโซโทปกัมมันตรังสีของธาตุชนิดหนึ่งๆ จะมีครึ่งชีวิตคงเดิมไม่ว่าจะอยู่ในรูปของธาตุหรือเกิดเป็นสารประกอบ เช่น
Na-24 มีครึ่งชีวิต 15 ชั่วโมง หมายความว่าถ้าเริ่มต้นมี Na-24 10 กรัม นิวเคลียสนี้จะสลายตัวให้รังสีออกมาจนกระทั่งเวลาผ่านไปครบ 15 ชั่วโมง จะมี Na-24 เหลือ 5 กรัม และเมื่อเวลาผ่านไปอีก 15 ชั่วโมงจะมี Na-24 เหลืออยู่ 2.5 กรัม นั้นคือเวลาผ่านไปทุกๆ 15 ชั่วโมง Na-24 จะสลายตัวไปเหลือเพียงครึ่งหนึ่งของปริมาณเดิม
ปฏิกิริยานิวเคลียร์
ปฏิกิริยาเคมีที่ได้ศึกษามาแล้ว เป็นการเปลี่ยนแปลงที่เกิดขึ้นกับเวเลนซ์อิเล็กตรอนของธาตุที่ทำปฏิกิริยากันทำให้เกิดเป็นสารใหม่ที่มีสมบัติแตกต่างไปจากเดิมและมีพลังงานเกี่ยวข้องไม่มาก ส่วนปฏิกิริยานิวเคลียร์เป็นการเปลี่ยนแปลงในนิวเคลียสของธาตุ อาจเกิดจากการแตกตัวของนิวเคลียสของอะตอมที่มีขนาดใหญ่หรือเกิดจากการรวมตัวของนิวเคลียสของอะตอมที่มีขนาดเล็ก จะได้ไอโซโทปใหม่หรือนิวเคลียสของธาตุใหม่ รวมทั้งมีพลังงานเกี่ยวข้องกับปฏิกิริยาเป็นจำนวนมหาศาล ซึ่งสามารถนำมาใช้ประโยชน์ได้ ตัวอย่างปฏิกิริยานิวเคลียร์ศึกษา
ปฏิกิริยาฟิชชันและปฏิกิริยาฟิวชัน
ในปี พ.ศ. 2482 นักวิทยาศาสตร์ได้ค้นพบว่าเมื่อยิงอนุภาคนิวตรอนไปยังนิวเคลียสของ U-235 นิวเคลียสจะแตกออกเป็นนิวเคลียสของธาตุที่เบากว่า
กระบวนการที่นิวเคลียสของธาตุหนักบางชนิดแตกออกเป็นไอโซโทปของธาตุที่เบากว่าดังตัวอย่างที่กล่าวมาแล้วเรียกว่า ปฏิกิริยาฟิชชัน (fission reaction) ธาตุอื่นที่สามารถเกิดปฏิกิริยาฟิชชันได้ เช่น U-238 หรือ Pu-239 การเกิดปฏิกิริยาฟิชชันแต่ละครั้งจะคายพลังงานออกมาจำนวนมากและได้ไอโซโทปกัมมันตรังสีหลายชนิด จึงถือได้ว่าปฏิกิริยาฟิชชันเป็นวิธีผลิตไอโซโทปกัมมันตรังสีที่สำคัญ นอกจากนี้ปฏิกิริยาฟิชชันยังได้นิวตรอนเกิดขึ้นด้วยถ้านิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่นๆ จะเกิดปฏิกิริยาฟิชชันต่อเนื่องไปเรื่อยๆ เรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่ (chain reaction)
ปฏิกิริยาฟิชชันที่เกิดขึ้นภายใต้ภาวะที่เหมาะสมจะได้จำนวนนิวตรอนเพิ่มขึ้นอย่างรวดเร็ว ทำให้ปฏิกิริยาฟิชชันดำเนินไปอย่างรวดเร็วและปล่อยพลังงานออกมาจำนวนมหาศาล ถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดอย่างรุนแรง หลักการของการเกิดปฏิกิริยาลูกโซ่เช่นนี้ได้นำมาใช้ในการทำระเบิดปรมาณู
ในกรณีที่นิวเคลียสของธาตุเบาสองชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่าเดิมและให้พลังงานปริมาณมาก
กระบวนการนี้เรียกว่า ปฏิกิริยาฟิวชัน (fusion reaction) ปฏิกิริยาทั้งสองนี้เป็นปฏิกิริยาเดียวกับที่เกิดขึ้นบนดวงอาทิตย์ซึ่งเป็นแหล่งพลังงานที่สำคัญของสุริยจักรวาลการเกิดปฏิกิริยาฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมากเพื่อเอาชนะแรงผลักระหว่างนิวเคลียสที่จะเข้ารวมกันซึ่งประมาณกันว่าจะต้องมีอุณหภูมิถึง 2 x 10^8 องศาเซลเซียส ความร้อนหรือพลังงานจำนวนนี้อาจได้จากปฏิกิริยาฟิชชันซึ่งเปรียบเสมือนเป็นปฏิกิริยาชนวนที่ทำให้เกิดปฏิกิริยาฟิวชัน
ถ้าพลังงานนิวเคลียร์ที่ปล่อยออกมาจากปฏิกิริยาฟิวชันเกิดขึ้นอย่างรวดเร็วจะเกิดการระเบิดอย่างรุนแรงแต่ถ้าควบคุมให้มีการปล่อยพลังงานออกมาอย่างช้าๆ และต่อเนื่องกัน จะให้พลังงานมหาศาลที่เป็นประโยชน์ต่อมนุษย์ปฏิกิริยาฟิวชันมีข้อได้เปรียบกว่าปฏิกิริยาฟิชชันหลายประการกล่าวคือ คายพลังงานออกมามาก สารตั้งต้นของปฏิกิริยาฟิวชันหาได้ง่ายและมีปริมาณมาก นอกจากนี้ผลิตภัณฑ์ที่เกิดจากปฏิกิริยาฟิวชันเป็นธาตุกัมมันตรังสีที่มีครึ่งชีวิตสั้นและมีอันตรายน้อยกว่าผลิตภัณฑ์จากปฏิกิริยาฟิชชัน
เทคโนโลยีที่เกี่ยวข้องกับการใช้สารกัมมันตรังสี
รังสีทำให้โมเลกุลของสารแตกตัวเป็นไอออนได้เป็นผลให้เกิดการเปลี่ยนแปลงที่เซลล์ของสิ่งมีชีวิต มนุษย์ไม่สามารถมองเห็นรังสีได้ด้วยตาเปล่าจึงต้องมีการตรวจสอบรังสีด้วยวิธีต่างๆ เช่น การใช้ฟิล์มถ่ายรูปหุ้มสารนั้น และเก็บไว้ในที่มืด ถ้าฟิล์มที่ล้างแล้วปรากฎสีดำแสดงว่าสารนั้นมีการแผ่รังสีหรือนำสารที่ต้องการตรวจสอบเข้าใกล้สารเรืองแสง ถ้าเกิดการเรืองแสงขึ้นแสดงว่าสารนั้นมีธาตุกัมมันตรังสีอยู่ แต่การตรวจสอบโดยวิธีที่กล่าวมาแล้วไม่สามารถบอกปริมาณของรังสีได้
สารกัมมันตรังสีแต่ละสารมีครึ่งชีวิตไม่เท่ากันและแผ่รังสีได้แตกต่างกัน การนำสารกัมมันตรังสีมาใช้ประโยชน์จึงแตกต่างกัน
ด้านธรณีวิทยา ใช้คาร์บอน -14 ซึ่งมีครึ่งชีวิต 5730 ปี หาอายุของวัตถุโบราณที่มีคาร์บอนเป็นองค์ประกอบ เช่น ไม้ กระดูก หรือสารอินทรีย์อื่นๆ การหาอายุวัตถุโบราณโดยการวัดปริมาณของคาร์บอน -14 อธิบายได้ว่าในบรรยากาศมีคาร์บอน -14 ซึ่งเกิดจากไนโตรเจนรวมตัวกับนิวตรอนจากรังสีคอสมิก
ด้านการแพทย์ ใช้เพื่อศึกษาความผิดปกติของอวัยวะต่างๆ ในร่างกาย โดยให้คนไข้รับประทานอาหารหรือยาที่มีไอโซโทปกัมมันตรังสีจำนวนเล็กน้อย จากนั้นใช้เครื่องมือตรวจสอบรังสีเพื่อติดตามดูผลการดูดซึมไอโซโทปกัมมันตรังสีของระบบอวัยวะต่างๆ เช่น ให้ดื่มสารละลายไอโอดีน -131 แล้วติดตามดูความผิดปกติของต่อมไทรอยด์ใช้ไอโอดีน -132 ติดตามดูภาพสมอง
ด้านเกษตรกรรม ใช้ไอโซโทปกัมมันตรังสีในการติดตามระยะเวลาของการหมุนเวียนแร่ธาตุในพืช โดยเริ่มต้นจากการดูดซึมที่รากจนถึงการคายออกที่ใบหรือจำนวนแร่ธาตุที่พืชสะสมไว้ที่ใบ เช่น ใช้ฟอสฟอรัส -32 จำนวนเล็กน้อยผสมกับฟอสฟอรัสที่ไม่มีรังสีเพื่อทำปุ๋ย แล้วใช้เครื่องไกเกอร์ มูลเลอร์ เคาน์เตอร์ ตรวจวัดรังสีที่ใบของพืชใช้รังสีเพื่อการปรับปรุงเมล็ดพันธุ์พืชให้ได้พันธุกรรมตามต้องการโดยการนำเมล็ดพันธุ์พืชมาอาบรังสีนิวตรอนในปริมาณและระยะเวลาที่เหมาะสมจะทำให้เกิดการกลายพันธุ์ได้
ด้านอุตสาหกรรม ใช้ไอโซโทปกัมมันตรังสีกับงานหลายอย่าง เช่น ใช้ตรวจหารอยตำหนิในโลหะหรือรอยรั่วของท่อขนส่งของเหลวโดยผสมไอโซโทปกัมมันตรังสีกับของเหลวที่จะขนส่งไปตามท่อ แล้วติดตามการแผ่รังสีด้วยเครื่องไกเกอร์ มูลเลอร์ เคาน์เตอร์ ถ้าบริเวณใดที่เครื่องมีสัญญาณจำนวนนับมากที่สุดแสดงว่าบริเวณนั้นมีการรั่วไหลเกิดขึ้น ใช้วัดความหนาของวัตถุเนื่องจากรังสีแต่ละชนิดทะลุวัตถุได้ดีไม่เท่ากัน ดังนั้นเมื่อผ่านรังสีไปยังแผ่นวัตถุต่างๆ เช่น โลหะ กระดาษ พลาสติก แล้ววัดความสามารถในการดูดซับรังสีของวัตถุนั้นด้วยเครื่องไกเกอร์ มูลเลอร์ เคาน์เตอร์ เปรียบเทียบจำนวนนับกับตารางข้อมูลก็จะทำให้ทราบความหนาของวัตถุได้
ในอุตสาหกรรมการทำอัญมณีใช้รังสีเพื่อทำให้อัญมณีมีสีสันสวยงามขึ้น โดยใช้รังสีแกมมา นิวตรอน หรือ อิเล็กตรอนพลังงานสูงฉายไปบนอัญมณี จะทำให้สารที่ทำให้เกิดสีบนอัญมณีเปลี่ยนสีไปได้ อัญมณีที่ฉายด้วยรังสีแกมมาจะไม่มีรังสีตกค้างแต่การอาบด้วยรังสีนิวตรอนจะมีไอโซโทปกัมมันตรังสีเกิดขึ้น จึงต้องปล่อยให้ไอโซโทปกัมมัมตรังสีสลายตัวจนมีระดับรังสีที่ปลอดภัยจึงนำมาใช้ประโยชน์
การเก็บถนอมอาหาร ใช้โคบอลต์ -60 ซึ่งจะให้รังสีแกมมาที่ไม่มีผลตกค้างและรังสีจะทำลายแบคทีเรียจึงช่วยเก็บรักษาอาหารไว้ได้นานหลายวันหลังจากการผ่านรังสีเข้าไปในอาหารแล้ว
การนำธาตุไปใช่ประโยชน์และผลกระทบต่อสิ่งมีชีวิต
มนุษย์นำธาตุมาใช้ประโยชน์ตั้งแต่อดีตกาล เช่น นำทองคำมาทำเครื่องประดับ นำเหล็กมาทำมีด นำทองแดงมาทำภาชนะเครื่องใช้ ในปัจจุบันมีการค้นพบและศึกษาสมบัติของธาตุมากขึ้นจึงมีการนำธาตุมาใช้ประโยชน์ได้หลากหลายมากขึ้น
ประโยชน์ของธาตุ
การจำแนกธาตุออกไปเป็นกลุ่มจะยิ่งทำให้ง่ายต่อการศึกษาและ การพิจารณาเพื่อนำไปใช้ เช่น
ธาตุโลหะ มีสมบัติการนำความร้อนและนำไฟฟ้าได้ดี จึงนิยมมาทำเป็นอุปกรณ์ไฟฟ้า เช่น นำทองแดงมาทำสายไฟฟ้า นำสังกะสีมาทำขั้วไฟฟ้าของถ่ายไฟฉาย นำโซเดียวมาทำเป็นตัวกลางแลกเปลี่ยนความร้อนและหล่อเย็นในปฏิกรณ์นิวเคลียร์
ผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม
ธาตุบางชนิดที่นำมาใช้ประโยชน์ก็ส่งผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม เช่น ตะกั่ว บัดกรี การปนเปื้อนของธาตุจำพวกนี้ ตามในดิน น้ำ อากาศ ส่งผลกระทบต่อการเจริญเติบโต ระบบโลหิต ระบบประสาท ปวดท้อง ท้องอืด ความจำเสื่อม ภูมิต้านทานลดลง และขัดขวางการทำงานของเอนไซม์ในร่างกาย แคดเมียมที่นำมาใช้ในอุตสาหกรรมผลิตอุปกรณ์ไฟฟ้า และแก๊สไฮโดรเจน ที่นำมาบรรจุในลูปโป่งหรือเรือเหาะ ก็ ทำให้มีโอกาสในการเกิดอุบัติเหตุร้ายแรงสูง จากแรงระเบิด
รวมถึงการใช้ พลังงานจากเตาปฏิกรณ์นิวเคลียร์ที่มีความอันตรายสูงมาก หากเกิดการระเบิดจะก่อให้เกิดความเสียหายอย่างมหาศาล และมีการกระจายของกัมมันตภาพรังสีซึ่งเป็นอันตรายต่อมนุษย์ในบริเวณกว้าง เป็นระยะเวลาอีกหลายร้อย หลายพันปี กว่าจะหมดไป
































ไม่มีความคิดเห็น:
แสดงความคิดเห็น